Hydroxid sodný sa vyrába elektrolýzou vodného roztoku chloridu sodného, ktorá prebieha v elektrolyzéroch dvoch základnych typov
1. so železnou katódou, katódový a anódový priestor je oddelený diafragmou
katóda: 2 H3O+ + 2 e- ---> H2 + 2 H2O
anóda: 2 Cl- ---> Cl2 + 2 e-
2 NaCl + 2 H2O ---> 2 NaOH + Cl2 + H2
2. s ortuťovou katódou ("amalgámová elektrolýza")
anóda: vylučuje sa chlór ako pri diafragmovej elektrolýze
2 NaHgx + 2 H2O ---> H2 + 2 NaOH + 2 x Hg
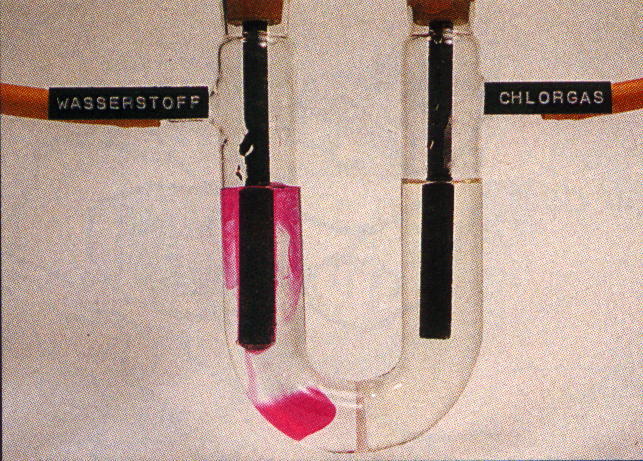 |
 |
||
| Obr.5 Získavanie hydroxidu sodného elektrolýzou kuchynskej soli |
Obr.6 Hydroxid sodný, ktorý sa nachá- dza v čistiacom prostriedku, leptá hliní- kový riad |
Hydroxid sodný sa používa na čistenie odpadov. Nachádza sa tiež v umývacom prostriedku do umývačiek. Veľa ťažkých úrazov poleptaním je preto, že sa tieto prostriedky často neuložia z dosahu detí. Veľké množstvá hydroxidu sodného sa používajú v chemickom priemysle na výrobu mydiel, celulózy, papiera, umelého hodvábu a na získavanie hliníka z bauxitu.
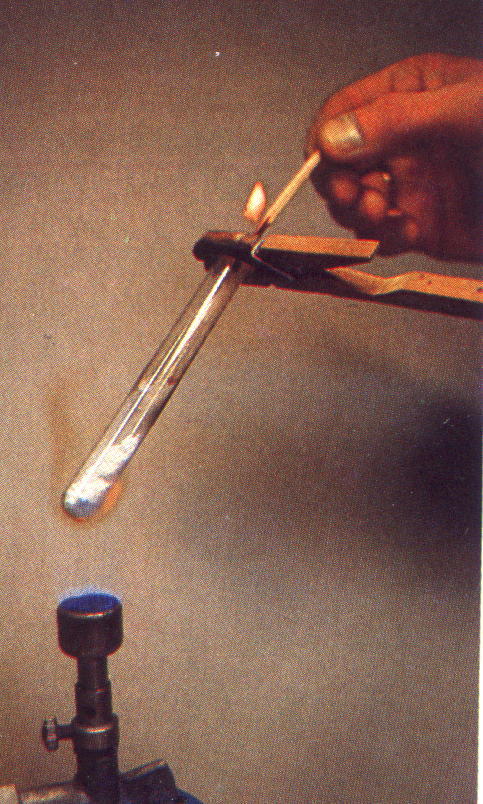 Oxid vápenatý sa vyrába pálením vápenca
Oxid vápenatý sa vyrába pálením vápenca
