Hlavné kvantové číslo
Každý elektrón v obale atómu má určitú
energiu. Hodnota hlavného kvantového čísla - n určuje
energiu elektrónu a zároveň
aj veľkosť orbitálu.
Hlavné kvantové číslo môže nadobúdať hodnoty
prirodzených čísel n = 1, 2, ...
Elektróny v stavoch s rovnakým n tvoria elektrónovú
vrstvu. Jednotlivé vrstvy sa označujú písmenami
K, L, M, N, O, P, Q pre n = 1, 2, ..., 7.

Vedľajšie kvantové číslo
Vedľajšie kvantové číslo - l udáva priestorový
tvar orbitálov a doplňuje energetický stav orbitálu.
Nadobúda hodnoty od l =0, 1, 2, ..., n-1 (pre každú
hodnotu n existuje n hodnôt čísla l, t. j. 0, 1, 2, ...,
n-i).
(pozri aj prehľadné tabuľky  ).
).
Hodnoty l sa zvyčajne
označujú písmenami:
|
hodnota
l |
0 |
1 |
2 |
3 |
|
typ
orbitalu |
s |
p |
d |
f |
Písmená s, p, d, f sa píšu
za hlavné kvantové číslo a hovoríme napr. o stave 1s,
2s, 2p, 3d atď. Energia orbitálov s rovnakým hlavným
kvantovým číslom n narastá v poradí s<p<d<f.

Magnetické kvantové číslo
Magnetické kvantové číslo - m udáva orientáciu
orbitálu v priestore. Počet hodnôt,
ktoré môže magnetické kvantové číslo nadobúdať(m =
-l, ..., -1, 0, 1, ... l) udáva počet orbitálov určitého
typu,
napr. pre n=2 a l=1 nadobúda m hodnoty -1, 0, 1
(pozri aj prehľadnú tabuľku  ).
).

Spinové kvantové číslo
V každom stave charakterizovanom tromi kvantovými číslami
(n, l, m) sa môžu nachádzať najviac dva elektróny,
ktoré sa líšia štvrtým kvantovým číslom. Toto číslo
sa nazýva spinové kvantové číslo - s a môže mať
len jednu z dvoch hodnôt: +1/2 alebo -1/2. 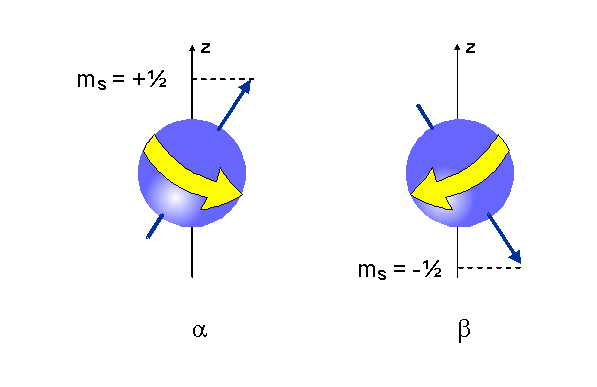
V každom orbitáli môžu byť maximálne
dva elektróny líšiace sa spinovým kvantovým číslom,
ktoré vytvárajú elektrónový pár.
(vzťahy medzi hodnotami kvantových čísel,
resp. ich rozličné kombinácie, viď. tabuľka  ).
).