2 CHÉMIA BEŽNÉHO ŽIVOTA
CHARAKTERISTIKA CHÉMIE KAŽDODENNÉHO ŽIVOTA
Mária GanajováChémia je dnes našim dennodenným spoločníkom. Či doma, na ceste do školy, v prírode, stále pozorujeme, skúmame, oboznamujeme sa s novými javmi, dejmi alebo látkami.
Celý náš život je spätý s chemickými reakciami. V domácnostiach sa používa asi pol milióna chemických produktov. Niektoré sú úplne neškodné, iné obsahujú agresívne kyseliny alebo zásady a vyvolávajú neželané zmeny v životnom prostredí. Je v našom záujme, aby sme poznali základné pravidlá správneho zaobchádzania s nimi. Preto sa ľudia čoraz častejšie oboznamujú s tajomstvami chémie, ktorá sa stáva súčasťou ich bežného života.
Pod pojmom chémia každodenného života vo všeobecnosti rozumieme zaoberanie sa látkami a dejmi, ktoré slúžia na uspokojovanie potrieb človeka. A. Maslow rozdelil potreby človeka do štyroch hierarchicky usporiadaných rovín:
| 1. základné podmienky pre prežitie (potrava, zdravie, oblečenie, bývanie a hygiena); |
| 2. ochrana proti nebezpečenstvám (potraviny, voda, vzduch); |
| 3. sociálna príslušnosť (komunikácia, kultúra, doprava); |
| 4. uznanie a sebarealizácia (práca, voľný čas, spolurozhodovanie, zodpovednosť). |
Každý stupeň tejto hierarchie potrieb súvisí s celým radom chemických dejov a procesov, z ktorých mnohé sú včlenené do vyučovania chémie, niektoré sú dokonca nosnými témami vyučovania chémie.
Pojem chémia každodenného života možno chápať v užšom a širšom zmysle slova:
V užšom zmysle slova - ako oblasť, ktorá sa zameriava na tri aspekty:
vyučovanie chémie - chémia každodenného života - spoločnosť
Témy sa majú voliť tak, aby obsahovali všetky tri aspekty "chémie každodenného života". Napr. pri preberaní témy Znečisťovanie ovzdušia sa žiaci oboznámia so škodlivými látkami, ktoré znečisťujú vzduch a so vznikom týchto látok. Chýbajú tu však informácie o možnosti nápravy, odstránenia alebo zníženia obsahu týchto škodlivín, ako aj ekonomická stránka tejto problematiky, t.j. náklady potrebné na realizáciu týchto náprav. Učiteľ by nemal zabudnúť informovať žiakov aj o týchto veciach.
V širšom zmysle slova - ako oblasť, ktorá sa zameriava na aspekty :
vyučovanie chémie - chémia každodenného života
Na vyučovacích hodinách sa témy preberajú podľa rámcových možností príslušného typu školy.
Výber situácií a javov musí byť prístupný, pochopiteľný, aby sa mohlo nadväzovať na už získané vedomosti, schopnosti a zručnosti žiakov. Napr. Znečisťujúce látky v ovzduší, ich vznik a odstránenie.
Môžu sa zameriavať na chémiu každodenného života a spoločnosť, pričom ale témy sú väčšinou mimo vyučovania chémie alebo na spoločnosť a vyučovanie chémie, a to sa vo veľkej miere týka problémov v rôznych odboroch chémie (napr. miesto spaľovne odpadkov, preprava zvláštneho odpadu a i).
Chémia každodenného života nie je len úzky pojem, ktorý sa môže jednoducho prevziať do vyučovania chémie, ale na základe požiadaviek každodenného života je tu daný variabilný rámec pojmu, ktorý závisí od odborných, didaktických a spoločenských možností učiteľa. Je teda v rukách učiteľa, aby tento potenciál pri vyučovaní chémie zúžitkoval.
BIOANORGANICKÁ CHÉMIA A VYUŽITIE JEJ POZNATKOV V PRAXI
Mária RehákováBioanorganická chémia je relatívne mladý interdisciplinárny vedný odbor, ktorej predmetom štúdia sú prvky v živých organizmoch - biokovy a niektoré nekovové prvky, ich funkcia, forma v akej sa nachádzajú, ich transport, procesy súvisiace s ich účasťou, ale aj účinky toxických prvkov, zlúčenín a iných jedov na biosystémy. Pojem biosystémy zahrňuje všetky živé organizmy - rastlinné, živočíšne, ľudský organizmus i mikroorganizmy. Poznatky bioanorganickej chémie sa v súčasnosti využívajú v rôznych oblastiach praxe.
Z celkového počtu prvkov periodickej sústavy v prírode sa nachádza zhruba 90 prvkov, v rôznych množstvách a koncentráciách. Približne 25 až 30 prvkoch sa podľa údajov súčasnej literatúry nachádza v biosystémoch. [1-6]. Veľmi dávno je známe, že určité kovové prvky majú zásadný význam pre správnu biologickú funkciu živých organizmov. Už pred mnohými storočiami sa jednoduché soli používali na terapeutické účely. V 17. storočí napr. bolo už známe, že železo je dôležité pre ľudský organizmus. Zásadná úloha niektorých ďalších iónov prechodných kovov však bola potvrdená až v priebehu posledných 50-60 rokov a neustále v súčasnej dobe pribúdajú novšie výsledky a informácie o ich forme a funkcii v živých organizmoch.
Tabuľka 1: Najrozšírenejšie prvky na zemskom povrchu, v oceánoch a ľudskom organizme v ich klesajúcom poradí [7]
| Zemský povrch | Oceán | Ľudský organizmus | ||
|---|---|---|---|---|
| O | O | H | ||
| Si | H | O | ||
| Al | Cl | C | ||
| Fe | Na | N | ||
| Ca | Mg | Na | ||
| Mg | S | K | ||
| Na | Ca | Ca | ||
| K | K | Mg | ||
| Ti | C | P | ||
| H | Br | S | ||
| P | B | Cl |
V živých organizmoch chemické prvky nie sú zastúpené v rovnakom poradí ako na zemskom povrchu. V tabuľke 1 sú uvedené najrozšírenejšie prvky v poradí ich klesajúceho výskytu na zemskom povrchu, v oceánoch a ľudskom organizme [7]. Napr. kremík a hliník patria po kyslíku medzi najrozšírenejšie prvky na zemskom povrchu, ale v ľudskom organizme ich prítomnosť pri rôznych funkciách nebola potvrdená.
Z uvedeného počtu chemických prvkov, ktoré sa nachádzajú v živých organizmoch, šesť prvkov má podstatnú úlohu. Sú súčasťou bielkovín, tukov, cukrov a nukleových kyselín. Sú to prvky:
Ďalších 12 prvkov má dôležitý význam pre činnosť živých organizmov. K nim patrí 10 kovových prvkov - tzv. biokovov:
makroelementy mikroelementy; stopové prvky
a dva nekovové prvky: Cl, I.
Medzi biokovy sú v súčasnosti zaradené aj ďalšie kovové prvky - ultramikrobiokovy, pretože sa nachádzajú vo veľmi nízkych koncentráciách: Cr, V, Ni .
Pre biosystémy sú potrebné aj ďalšie nekovové prvky: Si, B, Se, F.
V živých organizmoch boli nájdené aj niektoré ďalšie prvky , no ich prítomnosť, resp. funkcia je v súčasnosti predmetom štúdia.
Biokovy sú nevyhnutnou súčasťou živých organizmov. Podľa množstva v akom sú zastúpené v biosystémoch sa v literatúre označujú rôznymi názvami (makroelementy, mikroelementy, stopové prvky, esenciálne prvky a i.), podstatná je však ich funkcia. Biokovy sú dôležitou súčasťou biokoordinačných zlúčenín, vrátane biokatalyzátorov (napr. vitamín B12 obsahuje ako centrálny atóm kobalt), akumulátorov kyslíka (napr. myoglobín - červené svalové farbivo, uskladňuje kyslík vo svaloch, obsahuje ako centrálny atóm FeII), fotochemických systémov (napr. chlorofyl, obsahuje ako centrálny atóm MgII) a iných. Sodík a draslík, ktoré patria medzi neprechodné biokovy sú dôležité pre zachovanie normálneho osmotického tlaku, obsahu vody, pre udržanie acidobazickej rovnováhy v organizme, pre prenos plynov a dráždivosť nervov a svalov.
Kovové prvky, teda biokovy, sa nevyskytujú v organizme v elektroneutrálnom stave, ale vždy v určitom oxidačnom čísle. Z neprechodných biokovov sa sodík a draslík v biosystémoch vyskytujú vždy v oxidačnom čísle I, vápnik a horčík v oxidačnom čísle II. Pre prechodné biokovy (Fe, Co, Cu, Mn a Mo) je typický ich výskyt vo viacerých oxidačných číslach, zúčastňujú sa na oxidačno-redukčných reakciách s výnimkou zinku, ktorý sa vyskytuje iba v oxidačnom čísle II, čo vyplýva z jeho elektrónovej konfigurácie. Zastúpenie biokovov v ľudskom organizme s priemernou hmotnosťou 70 kg je uvedené v tabuľke 2.
Tabuľka 2: Zastúpenie niektorých biokovov v organizme človeka s priemernou hmotnosťou 70 kg [1,3,6]
| prvok | množstvo | prvok | množstvo | |||
|---|---|---|---|---|---|---|
| Ca | 1700 g | Fe | 5 g | |||
| K | 170 g | Zn | 2 g | |||
| Na | 70 g | Cu | 0.1 g | |||
| Mg | 42 g | ostatných biokovov | menej ako 0.1 g |
Ako jeden z príkladov nevyhnutnosti kovových prvkov pre živé organizmy môže byť železo v hemoglobíne. Hemoglobín zabezpečuje prísun kyslíka nevyhnutného pre životnú činnosť buniek. Mechanizmus tejto funkcie spočíva v tvorbe oxyhemoglobínu. Hemoglobín i oxyhemoglobín obsahujú vždy železo v oxidačnom čísle II. Hemoglobín sa však pôsobením rozličných oxidovadiel môže zmeniť na methemoglobín, v ktorom sa železo vyskytuje v oxidačnom čísle III. Methemoglobín je však pre prenos kyslíka bezcenný. Medzi takéto oxidovadlá patrí napr. anilín, nitrobenzén, dusitany. Tvorbu methemoglobínu spôsobujú aj rôzne drogy a liečivá. Ak sa zmenia 2/3 hemoglobínu na methemoglobín nastáva smrť zadusením.
Príkladom ultramikrobiokovov, ktoré sa nachádzajú v organizmoch vo veľmi nízkych koncentráciách je chróm. V oxidačnom čísle VI chróm je pre živé organizmy toxický [7,8]. (napr. vo forme chromanov, dichromanov), ale v oxidačnom čísle III vo veľmi nízkych koncentráciách (v µg množstvách) je esenciálnym prvkom. Nachádza sa v ľudskom organizme, v živočíchoch i v rastlinách. V ľudskom organizme a organizme vyšších živočíchov participuje na metabolizme cukrov, ale zasahuje aj do metabolizmu tukov [1,7,9]. Vplýva na aktivitu inzulínu. Chróm v oxidačnom čísle III z hľadiska jeho významu pre živé organizmy je celosvetovo študovaný najmä v súvislosti s riešením liečby ochorenia diabetes mellitus (cukrovky), ako aj problému boja s nadváhou. Ochorením diabetes mellitus trpí 5% populácie rozvinutých krajín na svete a rovnaké percento má sklon k tomuto ochoreniu.
Pre živé organizmy sú potrebné aj niektoré ďalšie nekovové prvky, okrem už spomínaných šiestich prvkov, ktoré tvoria základ živej hmoty (bielkoviny, tuky, cukry a nukleové kyseliny). Príkladom je selén a fluór. Selén bol v minulosti považovaný za výlučne toxický prvok pre biosystémy. No v posledných rokoch sa zistilo, že má určitú funkciu v biosystémoch, avšak vo veľmi nízkych koncentráciách (v µg množstvách i menších). Zvýšenie koncentrácie je toxické. Selén je antioxidant, znižuje škodlivé okysličovanie v bunkách, nedovoľuje poškodenie DNA. Jeho nedostatok u ľudí môže zvyšovať riziko nádorových i iných chorôb. Fluór v živých organizmoch sa nachádza v kostiach a zuboch. Je dôležitý aj z hľadiska znižovania tvorby zubného kazu. Vyššie množstvo fluóru však vedie k poruche vo vývoji zubnej skloviny. Fluoridy majú inhibičný vplyv na mnohé enzýmy. Fluór bráni metabolizmu ústnej mikroflóry inhibíciou bakteriálnych enzýmov. Znižuje vznik kyselín z cukrov, a tak bráni vzniku zubných kazov.
V súčasnosti poznáme niekoľko oblastí praktického využitia poznatkov bioanorganickej chémie. Uplatnenie majú:
- v medicíne
- vo farmácii
- poľnohospodárstve
- toxikológii
- ekológii
- v minerálnych biotechnológiách
- a niektorých ďalších oblastiach
Poznatky bioanorganickej chémie sa ukázali veľmi významné aj pri skúmaní biologických cyklov toxických prvkov (Hg, Pb, As a iné) v prírode, najmä vniknutie ich zlúčenín do organizmu.
Využitie bioanorganickej chémie v medicíne je založené predovšetkým na potrebe udržiavania koncentrácie biokovov normálne fungujúceho organizmu na presne určených hladinách. V tabuľke 3 sú uvedené príklady funkcie niektorých prvkov a zlúčenín v organizme.
Tabuľka 3: Príklady funkcie niektorých prvkov a zlúčenín v organizme [2]
| Časť ľudského tela | Prvok alebo zlúčenina | |
|---|---|---|
| štruktúrny základ kostí a zubov | Ca, P, F | |
| syntéza hemoglobínu | Fe, Co, Cu | |
| transport a skladovanie kyslíka | Fe | |
| tlak krvi a kontrola zrážanlivosti krvi | Na, Cl, NO, Ca | |
| kontrakcia svalov | Ca, Mg | |
| bunkové delenie | Ca, Fe, Co | |
| kontrola pH v krvi | Zn, CO2 | |
| funkcia štítnej zľazy | I |
Nedostatok niektorých biokovov v organizme spôsobuje rad chorôb. (tab.4). Napr. nedostatok železa spôsobuje anémiu, nedostatok medi vyvoláva deštrukciu ciev, nedostatok zinku prudko znižuje aktivitu mnohých enzýmov, atď. Ťažké choroby spôsobuje tiež nadbytok bioprvkov, ktoré sa zhromažďujú v tele ako výsledok porušenia činnosti systémov regulujúcich ich koncentráciu. Napr. pri nadbytku vápnika sa objavujú zrazeniny organického pôvodu v tvare "kameňov" a usadenín na stenách ciev.
Tabuľka 4: Niektoré ochorenia spôsobené nedostatkom (d) alebo nadbytkom (e) esenciálnych prvkov [2]
| Choroba | Prvok | |
|---|---|---|
| anémia | Fe ( d ), Co ( d ), Cu ( d ), Mo ( e ) | |
| pľúcne ochorenia | Si ( e ), Ni ( e ), Cr ( e ) | |
| psychické poruchy | Mn ( e ) | |
| struma | I (d , e ) | |
| zlyhanie srdca | Co ( e ) | |
| kŕče | Mg ( d ) |
Štruktúrny základ kostí a zubov tvoria hydroxylapatit, karbonátoapatit, ako aj fluoroapatit nasledovného zloženia:
| hydroxylapatit | Ca10(OH)2(PO4)6, resp. Ca2[(OH)(CaPO4)3] | |
| karbonatoapatit | 3Ca3(PO4)2.CaCO3.H2O | |
| fluoroapatit | Ca10F2(PO4)6 |
Uhličitan vápenatý tvorí exoskelety - škrupiny vajec, ulity mäkkýšov, atď.
Druhú polovicu 20. storočia možno charakterizovať rozvojom nových vedných odborov, medzi ktoré sa zaraďuje výskum a vývoj anorganických biomateriálov [1,2,10], vhodných na použitie v medicíne. Tento rozvoj biomateriálov vyplynul z potrieb súčasného vysokého životného tempa, prinášajúceho mnohokrát situácie, pri ktorých dochádza k ťažkým nehodám alebo úrazom spojených s vážnym poškodením určitej časti organizmu (napr. rozdrvením určitých častí kostí. atď).
Medzi anorganické biomateriály vhodné na implantáciu do živých organizmov patria: bioaktívne materiály, pripravené zvyčajne na báze vápenatých a fosforečných iónov, korundové materiály, ktoré sa považujú za bioinertné materiály. Medzi biotolerantné materiály sa zaraďujú kovy a ich zliatiny, ako napr. zlato, platina a iné.
Tabuľka 5: Príklady bioaktívnych materiálov vápenatofosforečnanového typu
| Chemické zloženie | Názov biomateriálu* | Pomer Ca:P | ||
|---|---|---|---|---|
| Ca(H2P04)2 | monokalcium fosfát | 0.5 | ||
| Ca3(PO4)2 | trikalcium fosfát oktakalcium | 1.5 | ||
| Ca8(HPO4)2(PO4)4.2H2O | fosfát, dihydrát | 1.33 | ||
| Ca10(OH)2(PO4)6 | hydroxylapatit | 1.67 | ||
| Ca10F2(PO4)6 | fluoroapatit | 1.67 |
Účinok niektorých liekov, ale aj jedov, je založený na blokovaní aktívnych kovových centier enzýmov. Niektoré koordinačné zlúčeniny sa používajú ako antimikróbne a antibakteriálne preparáty (napr. teracyklín rozrušuje ribozómy mikroorganizmov tým, že viaže ióny Mg2+).
V posledných desaťročiach sa veľká pozornosť venuje hľadaniu látok s potenciálnou protirakovinovou aktivitou. Koordinačné zlúčeniny platiny sú pre svoju vysokú protinádorovú aktivitu [1-6, 11-13] už takmer viac ako 35 rokov predmetom celosvetového záujmu chemikov, biológov a lekárov. Základom pre tento typ zlúčenín sa stala koordinačná zlúčenina platiny cis-diammin-dichloroplatnatý komplex, tzv. Peyronov chlorid alebo generickým (druhovým) názvom cis-platina.
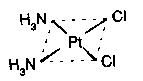
Táto zlúčenina bola prvýkrát zosyntetizovaná v roku 1845, ale jej novodobá história sa začala až po objavení jej pozoruhodných biologických účinkov. V roku 1965 Rosenberg a jeho spolupracovníci uverejnili správu o tom, že niektoré komplexné zlúčeniny platiny inhibujú bunečné delenie, nie však proteosyntézu, teda majú cytostatické pôsobenie. Bol však zistený rozdiel v biologickom účinku cis-platiny a trans izoméru. Trans izomér (trans-diammin-dichloroplatnatý komplex) nemá cytostatický účinok.
Cis-platina patrí medzi protinádorové chemoterapeutiká pre liečenie zhubných ochorení. Intenzívnym a všestranným výskumom koordinačných zlúčenín platiny bola pripravená celá rada analógov cis-platiny, ovšem iba niektoré boli protinádorovoaktívne, ako napr. tzv. karboplatin (s oveľa menšími bočnými účinkami ako cisplatina), spiroplatin a iné.
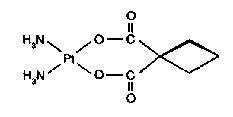
karboplatin
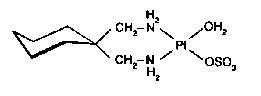
spiroplatin
Poznatky bioanorganickej chémie možno použiť aj pri riešení ďalšieho vážneho problému: odvrátenia znečistenia okolitého prostredia toxickými prvkami a ich zlúčeninami a hľadanie prostriedkov boja so znečistením [5,14]. Uplatňuje sa tu skúmanie mechanizmov mikrobiologického koncentrovania mikroelementov a procesov ich premeny v mikroorganizmoch na molekulovej úrovni. Úspechy minerálnych biotechnológií svedčia o možnosti využívania mikroorganizmov pri získavaní kovov [14].
Názvom minerálne biotechnológie sa vo všeobecnosti označujú všetky technologické postupy - ťažobné, úpravnícke a spracovateľské, v ktorých sa pre dosiahnutie potrebnej kvalitatívnej zmeny anorganických, ale aj organických nerastných surovín a ich odpadov, využívajú mikroorganizmy (MO) alebo produkty ich metabolizmu [14]. Klasický technologický trojzložkový systém, pevná fáza - kvapalná fáza - plynná fáza, je v prípade minerálnych biotechnológií rozšírený o štvrtú zložku - biofázu, ktorú tvoria spravidla autochtónne (na pôvodnom mieste v prírode sa vyskytujúce), chemolitotrófne (využívajúce anorganické látky) mikroorganizmy.
Biotechnológie sú vlastne jedným z najstarších prírodných procesov, ale paradoxné je, aj najmladším vedným odborom a odvetvím priemyselnej výroby. Vo svojej prirodzenej podstate začali na Zemi fungovať už miliardy rokov pred ľudskou činnosťou a boli, a stále vo väčšej miere sú, jedným z významných článkov kolobehu prvkov v litosfére, ktorá je súčasťou biosféry. V biosfére dochádzalo a dochádza k nespočetným biologicko-chemickým reakciám, ktoré sú podstatou základných biogénnych procesov biolúhovania, biorozkladu, biokorózie, biogenézy a bioakumulácie.
Tabuľka 6: Oxidačné schopnosti niektorých mikroorganizmov [14]
| Prvok | Forma výskytu | Mikroorganizmy schopné lúhovať | ||
|---|---|---|---|---|
| Cu | sulfidická | Thiobacillus ferrooxidans, Thiobacillus thiooxoidans, Leptospirillum | ||
| Mn | oxidická | Thiobacillus ferrooxidans, Bacillus circulans, B.polymyxa, B. ceresis, Achromobacter, Aspergillus niger, Pseudomonas aeruginosa | ||
| Zn | sulfidická | Thiobacillus thiooxidans, Thiobacillus ferrooxidans, Leptospirillum | ||
| Pb | sulfidická | Thiobacillus thiooxidans, Thiobacillus ferrooxidans, Leptospirillum | ||
| Sb | sulfidická | Thiobacillus thiooxidans, Thiobacillus Y , Stibiobacter, Thiobacillus thiocyanooxidans | ||
| As | sulfidická Iná As3+ | Thiobacillus ferrooxidans, Thiobacillus thiooxidans, Leptospirillum Pseudomonas putina, Alcaligenes eutrophus, Pseudomonas arzenooxidans | ||
| Ni | sulfidická | Thiobacillus ferrooxidans, Thiobacillus thiooxidans, Leptospirillum | ||
| Al | silikátová | Aspergillus niger, Penicillium glaucum, Penicillium brevicaule | ||
| Fe | Fe2+ v silikátoch | Thiobacillus ferrooxidans, Aspergillus niger, B.polymyxa, B. circulans, Penicillium species, Penicillium glaucum, Pseudomonas | ||
| Cd | sulfidická | Thiobacillus ferrooxidans, Thiobacillus thiooxidans Leptospirillum | ||
| Au | rýdza | Aeromonas Bacillus, Pseudomonas, B. megatherium, B. Wesenthericus niger, Pseudomonas liquefaciens, Aspergillus niger | ||
| Au, Ag | sulfidická | Thiobacillus ferrooxidans, Thiobacillus thiooxidans Leptospirillum |
Priamym dôsledkom biologicko - chemických reakcií v prírodnom prostredí je porušenie štruktúry pôvodných zlúčenín extrakciou niektorých stavebných prvkov až po jej úplnú degradáciu a následnú transformáciu na kvalitatívne odlišné nové zlúčeniny - sekundárne minerály.
Literatúra
1. Kaim, W., Schwederski, B.: Bioanorganic Chemistry. Inorganic Elements in the Chemisry of Life. John Wiley & Sons. Chichester 1994.
2. Wilkins, P.C., Wilkins, R.G.: Inorganic Chemistry in Biology. Oxford University Press, Oxford 1997.
3. Reháková, M.: Bioanorganická chémia. UPJŠ, Košice 1992.
4. Hay, R.W.: Bio-inorganic Chemistry. John-Wiley and Sons. New York 1989.
5. Reháková M., Kušnierová M.: Metodicko - pedagogické centrum Prešov, BIGECHE č. 4 (2002) 69-75.
6. Reháková M.: BIOLÓGIA, EKOLÓGIA, CHÉMIA roč.7, (1), 14-16 (2002).
7. Shriver, D.F., Atkins, P.W.: Inorganic Chemistry. Oxford University Press, Oxford 1999.
8. Kafka P., Punčochová J.: Chemické listy 96 (2002) 611.
9. Mennen B.: Dietary chromium: An Overview. http://www.healthfree.com/introchrom.htm.
10. Kukurová, E. (Ed.): Advances in Medical Physics, Biophysics and Biomaterials. MALÉ CENTRUM, Bratislava1997.
11. Kiss, P.: Sborník prednášek 42. sjezdu Československé společnosti chemické. Ostrava 1986, str.44.
12. Caret R.C., Denniston K.J., Topping J.J.: Principles and Applications of Inorganic. Organic and Biological Chemistry. WCB, Boston 1997.
13. Gebelein Ch.G.: Chemistry and our world. WCB, London 1997.
14. Kušnierová M., Fečko P: Minerálne biotechnológie I. TU-VŠB, Ostrava 2001.