Všeobecne o kyselinách a zásadách
Kyseliny boli kedysi charakterizované sfarbením lakmusového papierika na červeno, kyslou chuťou, vyvíjaním oxidu uhličitého z vápenca a rozpúšťaním neušľachtilých kovov za vývoja vodíka.Zásady zasa modrým zafarbením lakmusového papierika a zmydelňovaním organických esterov.
V zmysle Arrheniovej teórie je kyselina zlúčenina, ktorá sa vo vodnom roztoku ionizuje za vzniku vodíkových katiónov, zásada potom zlúčenina, ktorá sa ionizuje za vzniku hydroxidových aniónov. Napríklad kyselina dusičná sa ionizuje podľa schémy
hydroxid sodný podľa schémy
V zmysle Brönstedovej teórie sa za kyselinu považuje látka, ktorá je schopná odovzdávať protón (je donorom protónu) a za zásadu látka, ktorá môže protón prijímať (je akceptorom protónu). Každá kyselina K je spriahnutá so zodpovedajúcou zásadou Z, s ktorou tvorí tzv. konjugovanú dvojicu
Aby sa zdôraznil mimoriadny význam, aký prisudzuje táto teória protónu, kyseliny a zásady sa označujú ako protolyty a reakcie medzi nimi ako protolytické.
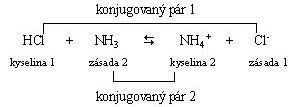
Funkcia Brönstedovej kyseliny alebo zásady sa môže prejaviť až po spojení dvoch konjugovaných sústav. Voľné protóny v roztokoch nie sú schopné existencie, a preto kyselina K1 môže svoj protón odštiepiť iba vtedy, ak je prítomná zásada Z2, ktorá by ho prijala a pritom vznikne nová kyselina K2 a zásada Z1. V roztoku teda prebiehajú vždy súčasne dva deje
HCl
kyselina protón zásada zásada protón kyselina
Každá z týchto dvojíc, líšiacich sa o protón, sa nazýva konjugovaný pár (protolytický systém). Pri protolytickej reakcii reaguje vždy kyselina jedného protolytického systému so zásadou druhého protolytického systému pričom vzniká nová kyselina a zásada.
V zmysleLewisovej teórie kyselina je látka, ktorá môže viazať voľný elektrónový pár inej častice, a je teda jeho akceptorom. (AlCl3, BCl3, FeCl3, H+, Co3+, ...)
Zásada je látka, ktorá je donorom voľného elektrónového páru. (NH3, ...)
Reakcia Lewisovej kyseliny a Lewisovej zásady je podmienená vznikom koordinačnej (donorovo-akceptorovej) väzby, napr.
Lewisova teória má význam predovšetkým v chémii koordinačných zlúčenín, kde všetky centrálne atómy sú akceptormi elektrónových párov (Lewisove kyseliny) a všetky ligandy sú donormi elektrónových párov (Lewisove zásady). Jej praktické využitie v chémii znižuje fakt, že také látky ako H2SO4, HCl a pod. v jej ponímaní nie sú kyseliny.
V zmysle Pearsonovej teórie každá molekula je zložená z kyslej a bázickej časti. R.G. Pearson vypracoval koncepciu posudzovania kyselín, príp. zásad podľa ich tvrdosti alebo mäkkosti. Pre tvrdé kyseliny je typický malý rozmer, vysoké kladné oxidačné číslo a dostatočne nízky sklon vonkajších elektrónových obalov k deformácií. Príklady tvrdých kyselín: H+, Li+, Na+, K+, Mg2+, Sc3+, BF3, AlCl3 a iné.
Mäkké kyseliny sú charakterizované nízkym alebo nulovým oxidačným číslom, veľkým rozmerom a ľahkou deformovateľnosťou vonkajšieho elektrónového obalu. Príklady mäkkých kyselín: Cu+, Ag+, Au+, Pd2+, Pt2+, Hg2+, InCl3, I2, Br2 a iné.
Tvrdé zásady sú potom také, ktorých vonkajšie elektrónové obaly nie sú náchylné k deformácii. Príklady tvrdých zásad: H2O, OH-, F-, Cl-, PO43-, SO42-, ClO4-, CO32- a iné.
Mäkké zásady majú ľahko deformovateľné vonkajšie elektrónové obaly. Príklady mäkkých zásad: I-, SCN-, S2O32-, CN-, CO, H-, R3P, R3As (R-alkyl) a iné.
Koncepcia tvrdých a mäkkých kyselín a zásad vychádza z princípu, že tvrdá kyselina uprednostňuje koordináciu s tvrdou zásadou a mäkká kyselina koordináciu s mäkkou zásadou. Podľa toho v reakcii
je Z1 mäkšou zásadou ako Z2, ak Kc > 1. Predstavám o tvrdých a mäkkých kyselinách a zásadách je ťažko dať kvantitatívny základ a táto koncepcia sa prevažne používa ako užitočné vodidlo pri objasňovaní rôznych chemických reakcií a empirických faktov.
Záporný dekadický logaritmus koncentrácie vodíkových iónov označujeme pH. Hodnoty pH môžu byť v rozsahu 0 - 14. Roztoky s hodnotou pH od 0 - 7 sú kyslé roztoky. Neutrálne roztoky majú hodnotu pH = 7, zásadité roztoky od 7 - 14. Čím je hodnota pH menšia, tým je roztok kyslejší a naopak, čím je hodnota pH väčšia, tým je roztok zásaditejší. Hodnota pH je mierou obsahu vodíkových alebo hydroxidových iónov.
Hodnoty pH sa určujú indikátormi. Indikátory sú organické kyseliny alebo zásady, ktoré menia svoju farbu zmenou koncentrácie vodíkových iónov v roztoku, preto sa pomocou nich dá stanoviť pH. Indikátory menia svoje zafarbenie v rôznom rozsahu pH, buď v celej oblasti pH od 0 - 14 (univerzálny indikátor), alebo len v určitom rozsahu (metyloranž, metylčerveň, lakmus, ...). Hodnoty pH stanovujeme indikátorovými papierikmi, alebo na presnejšie merania používame elektrické meracie prístroje, tzv. pH - metre.
Čistiace prostriedky sú silno kyslé roztoky (hodnota pH asi 0,5). Väčšina potravín má hodnotu pH od 2 - 4 alebo slabú kyslosť od 4 - 6. Rastliny optimálne rastú len pri určitých hodnotách pH. Šalát potrebuje pôdu s hodnotou pH od 6 - 7, jahody uprednostňujú slabo zásadité pôdy s hodnotou pH 7,5 - 8,5. Silne zásadité roztoky sú pracie prostriedky a prostriedky na čistenie odtokov s hodnotou pH od 10 - 13. Hodnota pH má rozhodujúci význam pre život. Napríklad ryby potrebujú k životu vo vode hodnotu pH od 6,5 do 8,5.