UČEBNÉ TEXTY
3
Energetické zmeny pri vzniku chemickej väzby
Prejavom stálosti molekúl vzhľadom k atómom je uvoľňovanie energie pri tvorbe chemických väzieb. Naopak,
na ich štiepenie je potrebné energiu dodávať. Energia, ktorá sa
spotrebuje na rozštiepenie chemickej väzby je rovnaká, ako energia,
čím
je hodnota väzbovej energie väčšia, tým je väzba pevnejšia.
Tab. č. 1: Príklady väzbových
energií niektorých molekúl
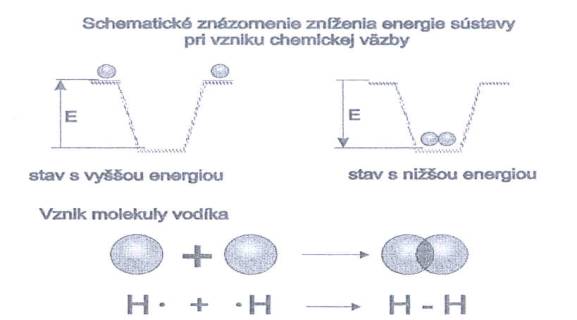
Pri vzniku chemickej väzby dochádza ku zníženiu energie sústavy (obr. č. 5). Obr. č. 5: Schematické znázornenie zníženia
energie sústavy pri vzniku chemickej väzby
|
Posledná aktualizácia: 12.05.2008