UČEBNÉ TEXTY
|
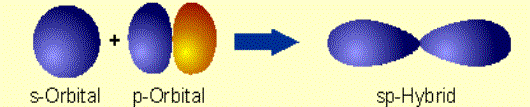
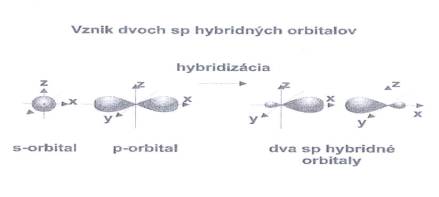
2.1 Hybridizácia SP Lineárnou
kombináciou jedného atómového orbitalu s a jedného atómového
orbitalu p vzniknú dva energeticky rovnocenné hybridné orbitaly
– sp.
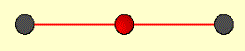
V priestore sú umiestnené pozdĺž priamky – lineárne,
zvierajú uhol 180°.
Obidva orbitaly sp sú energeticky rovnocenné. Ich energia
je väčšia ako energia pôvodného orbitalu s a menšia
ako energia orbitalu p.
Obr. č. 4: Ukážka vzniku hybridných orbitalov sp a ich lineárneho usporiadania
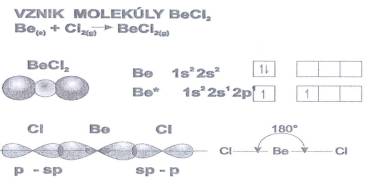
Obr. č. 5: Ukážka vzniku dvoch sp hybridných orbitalov Hybridizácia SP umožňuje
vysvetliť vznik väzieb v molekule chloridu berylnatého BeCl2.
Atóm berýlia má v základnom stave vo valenčnej vrstve len
spárené elektróny (2s2). Na utvorenie väzieb používa
hybridné orbitaly sp, ktoré sa prekrývajú s 3px
orbitalmi atómov chlóru. Dôsledkom prekrytia vznikajú
ekvivalentné väzby Be – Cl v molekule BeCl2. Vznik
dvoch rovnocenných väzieb umožňuje vysvetliť obr. č. 6.
Obr. č. 6: Ukážka vzniku 2 hybridných orbitalov sp
a vzniku väzieb v molekule BeCl2 Hybridné orbitaly sp majú na polovicu charakter orbitalov s a na polovicu charakter orbitalov p.
|
Posledná aktualizácia: 05.10.2004