UČEBNÉ TEXTY
|
2.2
Hybridizácia SP3 Lineárnou
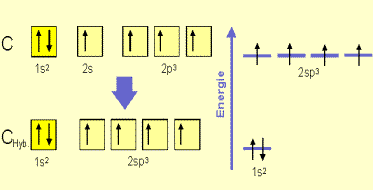
kombináciou jedného atómového orbitalu s a troch atómových
orbitalov p vzniknú štyri energeticky rovnocenné hybridné
orbitaly sp3,
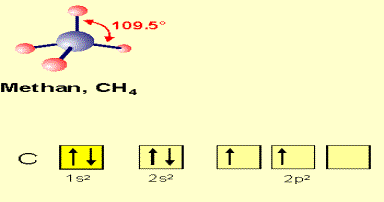
ktoré v priestore smerujú do vrcholov tetraédra (majú tetraedrickú
symetriu) a zvierajú uhly 109°28¢.
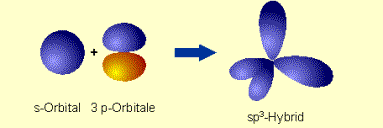
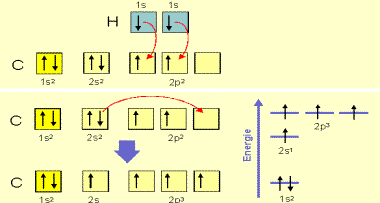
Obr.
č. 9: Ukážka vzniku hybridných orbitalov sp3 a ich
tetraedrického usporiadania
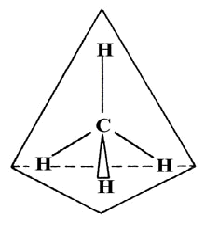
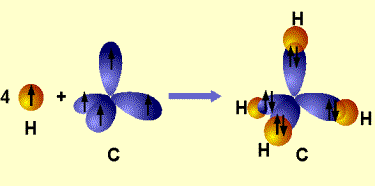
Obr. č. 10: Ukážka vzniku hybridných orbitalov sp3 Príkladom hybridizácie sp3 je vznik štyroch rovnocenných väzieb v molekule metánu CH4 (obr. č. 10, 11).
Obr. č. 11: Ukážka chemických väzieb v molekule metánu
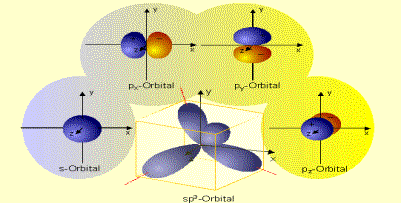
Obr. č. 12: Ukážka vzniku
hybridných orbitalov sp3 v molekule metánu Každý orbital sp3 má 25 % s a 75 % p charakteru.
|
Posledná aktualizácia: 05.10.2004