UČEBNÉ TEXTY
|
2.2
Hybridizácie SP3D
a SP3D2 Existujú
aj zložitejšie hybridizácie, kedy sa na hybridizácii v atóme
zúčastňujú nielen atómové orbitaly s a p, ale aj
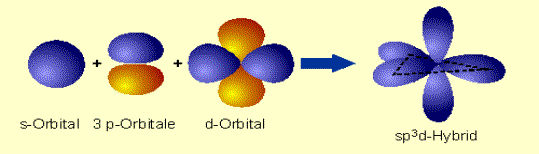
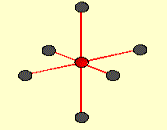
orbitaly d. Kombináciou
jedného orbitalu s, troch p a jedného orbitalu d vznikne 5
hybridných orbitalov sp3d, ktoré smerujú zo
stredu do vrcholov trigonálnej bipyramídy
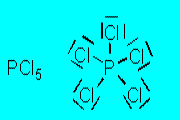
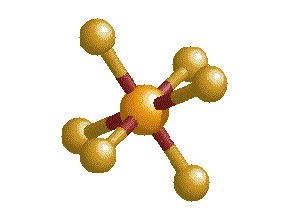
(napr. v molekule PCl5).
Obr. č. 13: Ukážka vzniku
hybridných orbitalov sp3d
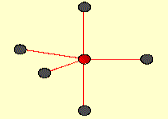
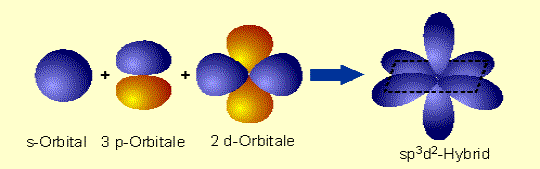
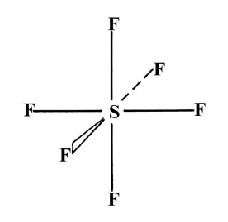
Obr. č. 14: Ukážka molekuly PCl5 a jej tvaru trigonálnej bipyramídy Kombináciou jedného orbitalu s, troch orbitalov p a dvoch orbitalov d vznikne 6 hybridných orbitalov sp3d2. Tieto orbitaly majú oktaedrickú symetriu, zvierajú 90° a 180° uhly. Príkladom oktaedrických molekúl je molekula SF6.
Obr. č. 15: Ukážka vzniku hybridného orbitalu sp3d2
Obr. č. 16: Ukážka molekuly SF6
a jej oktaedrickej symetrie
Teória
hybridizácie je vhodná na vysvetlenie vzniku väzieb v mnohých
molekulách a na určenie priestorovej štruktúry molekúl,
ale má aj svoje obmedzenia a je ťažko použiteľná pri zložitejších
molekulách.
|
Posledná aktualizácia: 05.10.2004