UČEBNÉ TEXTY
|
5.2
Iónová väzba
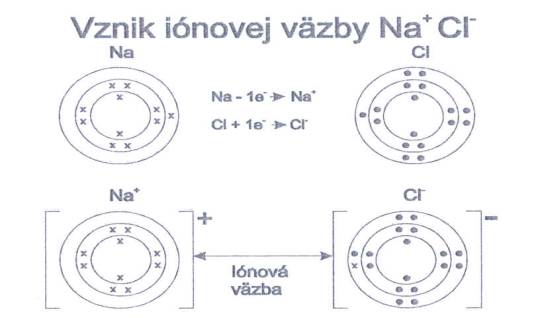
Ku vzniku iónovej väzby dochádza medzi atómami, ktorých rozdiel
elektronegativít je väčší ako 1,7 (väzba
medzi prvkami umiestnenými v periodickej tabuľke ďaleko od seba). a)
Atóm odovzdá elektrón (elektróny) druhému atómu, s ktorým interaguje a tým
získa elektrónovú konfiguráciu vzácneho plynu. Z pôvodného
atómu potom vzniká katión
– kladne nabitý ión. Napr.:
b) Atóm prijme elektrón (elektróny) od iného atómu, s ktorým interaguje a tým
nadobudne elektrónovú konfiguráciu vzácneho plynu. Z pôvodného
atómu vznikne anión
– záporne nabitý ión. Napr.: Cl + 1e- ®
Cl-
Obr. č. 28: Ukážka vzniku iónovej väzby v NaCl
Medzi
vzniknutými iónmi pôsobia silné elektrostatické príťažlivé sily,
ktoré sú podstatou vzniku iónovej väzby
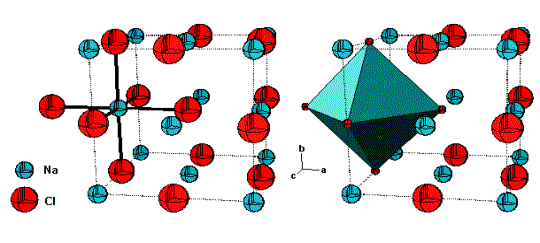
Obr. č. 29: Modely kryštálovej
štruktúry chloridu sodného NaCl
|
Posledná aktualizácia: 03.10.2004