UČEBNÉ TEXTY
|
5.2.1 Štruktúra a vlastnosti iónových zlúčenín Prejavom
pravidelnej vnútornej štruktúry iónových zlúčenín je ich kryštalický
tvar. Kryštály
sa
vyznačujú pravidelným tvarom. Ich povrch tvoria rovinné kryštálové
plochy,
ktoré sa pretínajú v kryštálových
hranách
a hrany
vo vrcholoch.
Geometrický tvar kryštálov nezávisí od ich veľkosti. V kryštáloch
určitej látky zvierajú navzájom zodpovedajúce dvojice plôch rovnaké
uhly. Napríklad
v kryštáloch chloridu sodného, ktoré majú tvar kocky,
zvierajú dve susedné plochy uhol 90°. Význačnou
vlastnosťou kryštálov je ich súmernosť, na základe ktorej sa rozdeľujú do siedmich kryštálových
sústav.
Najmenšie stavebné častice
kryštálov
– atómy, ióny alebo molekuly – sú usporiadané do pravidelnej
kryštálovej štruktúry. V každej kryštálovej štruktúre
možno určiť základnú bunku ako jednoduché zoskupenie častíc, ktoré sa
pravidelne opakuje v celom kryštále. Celú štruktúru si môžeme
predstaviť ako poskladanú z jednotlivých
základných buniek. V iónových zlúčeninách sa základná
bunka kryštálovej štruktúry skladá z iónov. V iónovom
kryštále je každý ión obklopený najväčším možným počtom opačne nabitých
iónov. Usporiadanie iónov v základnej
bunke závisí od pomeru veľkostí aniónov a katiónov, ktoré
si môžeme predstaviť ako vzájomne sa dotýkajúce gule. Ióny v kryštáloch sú pútané veľkými
elektrostatickými silami. Preto majú iónové
zlúčeniny vysoké
teploty topenia a varu (napr. teploty 600°C až 2000°C). V tuhom skupenstve
sú
iónové zlúčeniny elektricky
nevodivé. Ich
roztoky a taveniny
vedú
elektrický prúd.
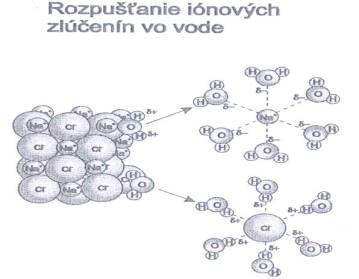
Dôsledkom vnútornej stavby iónových zlúčenín je aj ich krehkosť a dobrá rozpustnosť v polárnych rozpúšťadlách, napr. vo vode.
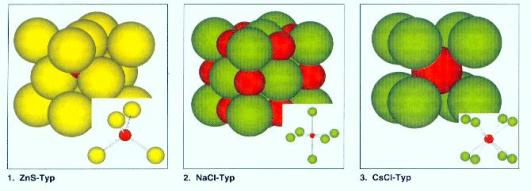
Obr. č. 30: Modely kryštálových
štruktúr ZnS, NaCl a CsCl
Obr. č. 31: Ukážka rozpúšťania
iónových zlúčenín vo vode Okrem iónových kryštálov
existujú aj atómové
kryštály,
ktoré tvoria kovalentne
viazané atómy. Štruktúru
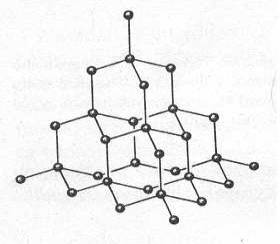
tohto typu má napr. diamant (obr. č.32).
Obr. č. 32: Model kryštálovej štruktúry diamantu Pri zmene skupenstva týchto látok nastáva štiepenie tuhých kovalentných väzieb, preto látky majú vysokú teplotu topenia (väčšinou nad 1000 ° C) a v tuhom skupenstve sú veľmi tvrdé. Atómové kryštály sa v bežných rozpúšťadlách nerozpúšťajú a nevedú elektrický prúd.
|
Posledná aktualizácia: 04.10.2004