UČEBNÉ TEXTY
|
5.1.2
Jednoduchá
a násobná väzba a) Kovalentná
väzba sa môže vytvoriť medzi rovnakými atómami,
ktoré môžu spoločne vlastniť jeden väzbový elektrónový pár.
Táto väzba sa označuje ako jednoduchá kovalentná väzba,
napr. v molekule H2, Cl2.
Obr. č. 11: Ukážka
jednoduchej kovalentnej väzby v molekule etánu Ak atómy v molekule spoločne vlastnia dva alebo tri väzbové elektrónové páry, hovoríme o násobnej kovalentnej väzbe, dvojitej a trojitej, napr. molekula eténu s dvojitou väzbou.
Obr. č. 12: Ukážka dvojitej väzby
v molekule eténu Keď sú dva atómy viazané 1 väzbou σ a 1 väzbou π, vzniká dvojitá kovalentná väzba. V prípade, že sú dva atómy viazané 1 väzbou σ a 2 väzbami π, vzniká trojitá kovalentná väzba.
Obr. č. 13: Ukážka trojitej väzby v molekule etínu
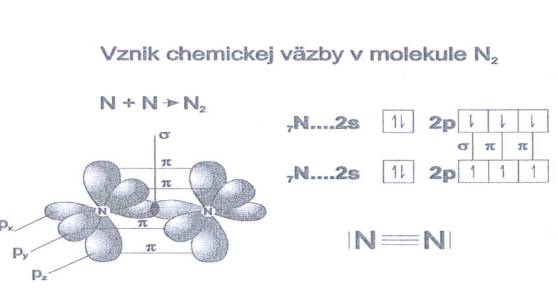
Obr. č. 14: Ukážka trojitej väzby v molekule dusíka
Vznik väzieb σ
a π
vysvetlíme na molekule N2. Elektrónová konfigurácia
valenčnej sféry atómu dusíka je: 2s2 2px1
2py1 2pz1. Za
predpokladu, že spojnicou jadier je os x, prekrytím 2px
atómov dusíka vznikne väzba σ.
Keďže orbitaly 2py
a 2pz sú
kolmé na os x, potom pri prekrytí 2py - 2py a
2pz - 2pz vzniknú dve väzby π.
V molekule dusíka je trojitá kovalentná väzba (obr. č. 14,
15).
Obr. č. 15: Ukážka vzniku
trojitej kovalentnej väzby v molekule dusíka V tejto
súvislosti sa používa aj pojem väzbový poriadok, ktorý možno chápať ako počet väzieb, ktorý spája dva atómy.
V molekule N2 sa väzbový poriadok rovná 3. b) Kovalentná väzba sa môže vytvoriť aj medzi rôznymi atómami,
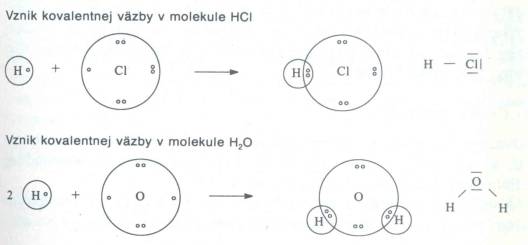
napr. v molekule HCl a v H2O.
Obr. č. 16: Ukážka vzniku kovalentnej väzby v molekulách
HCl a v H2O Pevnosť
väzby
rastie s násobnosťou väzby. Dĺžka chemickej väzby
(vzdialenosť stredov jadier viazaných atómov) klesá s násobnosťou
väzby. |
Posledná aktualizácia: 12.05.2008