UČEBNÉ TEXTY
|
5.1.5
Koordinačná kovalentná väzba Kovalentná
väzba môže vznikať aj tak, že obidva elektróny poskytne len jeden partner.
Vo valenčnej vrstve druhého väzbového partnera musí byť voľný
orbital. Vzniknutá väzba sa nazýva koordinačno – kovalentná
alebo skrátene koordinačná väzba. Častica,
ktorá
poskytuje na vytvorenie väzby elektrónový pár, sa nazýva donor
(darca)
a častica, ktorá prijíma väzbový elektrónový pár, sa
nazýva akceptor (príjemca). Preto sa koordinačná väzba nazýva aj donorno – akceptorová
väzba. Príkladom
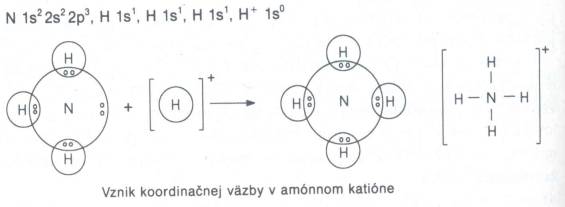
takejto väzby je väzba v amónnom katióne NH4+.
Donorom väzbového elektrónového páru je atóm dusíka a akceptorom
je katión vodíka.
Obr. č. 23:
Vznik koordinačnej väzby v amónnom katióne Kovalentná
a koordinačná väzba sú rovnaké, líšia sa len spôsobom
ich vzniku. Schopnosť vytvárať koordinačné väzby majú hlavne
d prvky, ktoré majú voľné d orbitaly. Tieto prvky sa často zúčastňujú
na tvorbe koordinačných
(komplexných) zlúčenín.
V týchto zlúčeninách sa donor nazýva ligandom,
akceptor sa nazýva centrálnym atómom. Počet ligandov,
ktoré sa viažu na centrálny atóm, udáva koordinačné číslo. Jadrá
viazaných atómov môžu
ležať buď na jednej priamke, potom hovoríme o lineárnej
molekule alebo neležia na jednej priamke a molekula
je lomená. Uhol medzi väzbami vychádzajúci z toho
istého atómu sa nazýva väzbový uhol. V molekule
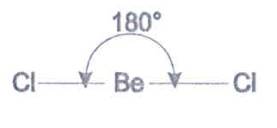
chloridu berylnatého BeCl2 sú dva väzbové elektrónové
páry. Najmenšej energii zodpovedá maximálny väzbový uhol, t.
j. 180°
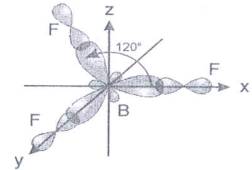
- molekula je lineárna. Molekula fluoridu boritého BF3 má tri väzbové elektrónové páry. Atómové jadrá troch atómov fluóru sa nachádzajú vo vrcholoch rovnostranného trojuholníka, v strede ktorého je atóm bóru B. Väzbový uhol je 120°.
Obr. č. 24: Modely molekúl BeCl2
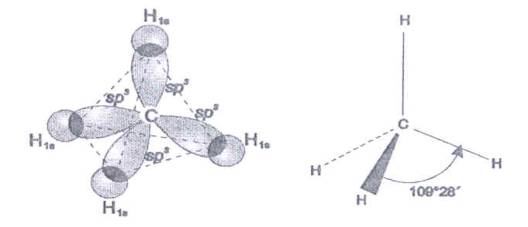
a BF3 V molekule metánu CH4 sa atómové jadro uhlíka nachádza v strede pravidelného štvorstena, v ktorého vrcholoch sú atómové jadrá vodíka. Väzbový uhol je 109° 28¢.
Obr. č. 25: Model molekuly metánu
CH4 V niektorých
molekulách sa okrem väzbových elektrónových párov nachádzajú
vo valenčnej vrstve centrálneho atómu aj voľné elektrónové
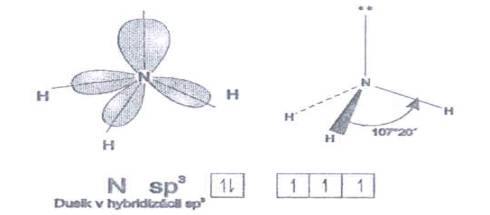
páry. Napr. v molekule amoniaku NH3 tri väzby
smerujú zo stredového atómu dusíka N do troch vrcholov štvorstena
s atómami vodíka H, pričom do štvrtého vrcholu smeruje
orbital obsahujúci voľný elektrónový pár. Odpudzovanie medzi
voľným a väzbovým elektrónovým párom je vždy väčšie,
ako odpudzovanie medzi dvoma väzbovými pármi, preto väzbový
uhol v molekule amoniaku je len 107°
20¢.
Obr. č. 26: Model molekuly
amoniaku NH3 Model
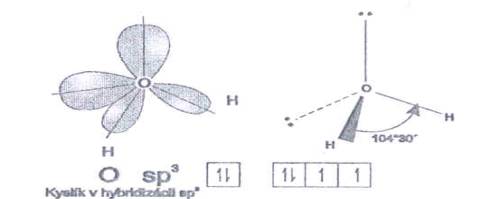
molekuly vody predstavuje štvorsten, v strede ktorého
je atómové jadro kyslíka. V dvoch vrcholoch sú atómové
jadrá vodíka a k ďalším dvom vrcholom smerujú
orbitaly obsahujúce voľné elektrónové páry, ktorých prítomnosť
zvyšuje odpudzovanie medzi elektrónmi vo valenčnej vrstve centrálneho
atómu kyslíka a väzbový uhol má len 104°
30¢.
Obr. č. 27: Model molekuly vody H2O
|
Posledná aktualizácia: 03.10.2004