UČEBNÉ TEXTY
|
5.1.4
Polárna a nepolárna
väzba Ak
je molekula tvorená len
atómami toho istého prvku, napr. Cl2, O2,
N2 atómy sú viazané nepolárnou
kovalentnou väzbou. V týchto molekulách je hustota elektrónového náboja väzbových
elektrónových párov rovnomerne rozdelená medzi jadrami viazaných
atómov. Ak je molekula tvorená atómami rôznych prvkov, napr. HCl, CO, NO2, NH3, H2O, potom dochádza k deformácii a posunu väzbového elektrónového páru do blízkosti atómu, ktorý má väčšiu hodnotu elektronegativity, teda väčšiu schopnosť priťahovať elektróny. Na atómoch v molekule potom vznikajú čiastkové (parciálne) náboje a väzba medzi atómami sa nazýva polárna kovalentná väzba.
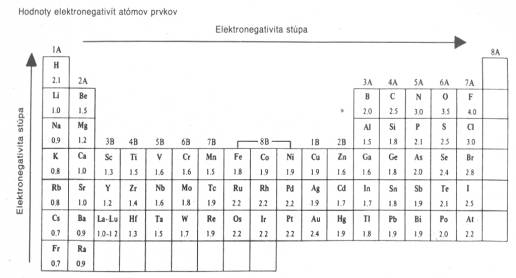
Obr. č. 18: Ukážka polárnej kovalentnej väzby v molekule HCl Schopnosť kovalentne viazaného atómu pútať k sebe väzbový elektrónový pár nazývame elektronegativita (X) (podľa Paulinga). Hodnoty elektronegativít pre jednotlivé prvky určili Pauling a Mulliken. Hodnoty elektronegativít prvkov nadobúdajú hodnoty z intervalu <0,86 – 4, 0>. Najväčšiu hodnotu elektronegativity má fluór (X = 4), je teda najelektronegatívnejším prvkom, má najväčšiu schopnosť priťahovať k sebe väzbový elektrónový pár (elektrónový oblak). Čím majú prvky väčšiu hodnotu elektronegativity, tým majú ich atómy väčšiu schopnosť pútať väzbový elektrónový pár.
Obr. č. 19: L. C. Pauling
Obr. č. 20: R. S. Mulliken Hodnota elektronegativity v perióde
stúpa zľava doprava, v stĺpci zdola nahor
(obr. č. 21).
Obr. č.
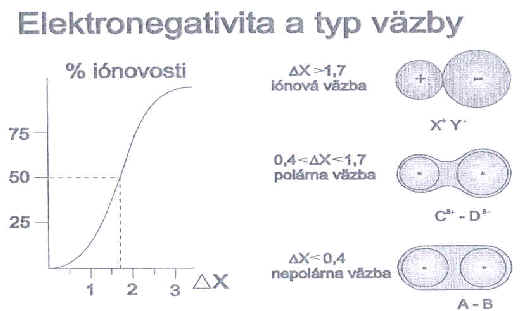
21: Ukážka smeru rastu hodnôt elektronegativity v perióde a v skupine Miera polarity kovalentnej väzby je určená
rozdielom elektronegativít prvkov, ktoré tvoria danú chemickú väzbu. Na základe rozdielu hodnôt elektronegativít atómov
A a B viazaných prvkov v molekule väzby rozdeľujeme na
jednotlivé typy:
Tab. č. 2: Rozdelenie jednotlivých typov väzieb na základe rozdielu elektronegativít
|
Posledná aktualizácia: 03.10.2004