UČEBNÉ TEXTY
|
Názov
školy: PRÍPRAVA
NA VYUČOVACIU
HODINU CHÉMIE
2.
hodina
Meno
vyučujúceho:
Dátum:
................................................................................................................................................. Ročník a trieda: ................................................................................................................................... Téma vyučovacej hodiny: ENERGIA, SYSTEMATIKA
CHEMICKÝCH Väzieb Výchovno-vzdelávací cieľ: vedieť
vysvetliť energetické zmeny spojené so vznikom a zánikom väzieb,
vedieť posúdiť vzťah energetických zmien s pevnosťou väzby,
vedieť definovať pojmy disociačná a väzbová energia a poznať
ich význam, vytvoriť si predstavu o existencii jednotlivých
typov väzieb, Typ
vyučovacej hodiny: klasická
vyučovacia hodina kombinovaného typu Použité
vyučovacie metódy: a)
Verifikačné metódy: individuálne ústne skúšanie 1 študenta b)
Metódy priameho prenosu poznatkov: výklad, vysvetľovanie c)
Metódy sprostredkovaného prenosu poznatkov: demonštrácia
pomocou CD nosiča, ukážka obrazov d)
Fixačné metódy: upevniť učivo pomocou úloh z učebného
textu Použité vyučovacie pomôcky: farebné
kriedy, učebné texty,
CD nosič „Animovaná chémia“, disketa s obrázkami Použitá didaktická technika:
počítač Štruktúra
vyučovacej hodiny: 1.
Organizačná časť: Ø
zápis do triednej knihy, prezencia 2.
Verifikačná časť: Ø
ústne individuálne skúšanie 1 študenta 3.
Expozičná časť: Ø
Výklad:
3 ENERGETICKÉ ZMENY PRI VZNIKU CHEMICKEJ VäZBY Ø
uvoľňovanie
energie pri tvorbe chemických väzieb Ø
na
ich štiepenie treba energiu dodávať Ø
Energia,
ktorá sa spotrebuje na rozštiepenie chemickej väzby je rovnaká,
ako energia, ktorá sa uvoľní pri jej vzniku. Energia, ktorá je
potrebná na rozštiepenie chemickej väzby, sa nazýva disociačná
energia väzby alebo väzbová energia. Podľa
väzbových energií môžeme porovnávať pevnosť chemických
väzieb: čím je hodnota väzbovej energie väčšia, tým
je väzba pevnejšia.
Tab. č. 1: Príklady väzbových energií niektorých molekúl Úloha:
Zostavte
podľa tab. č. 1 : a) poradie halogénov podľa stálosti ich
dvojatómových molekúl b) poradie uvedených molekúl od najnižšej
po najvyššiu hodnotu energie Ø
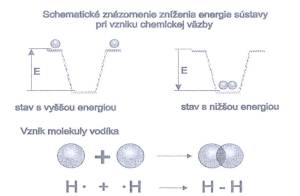
Pri
vzniku chemickej väzby dochádza ku zníženiu energie sústavy
(obr. č. 4).
Obr.
č. 5: Schematické znázornenie zníženia energie sústavy pri
vzniku chemickej väzby 4 Systematika
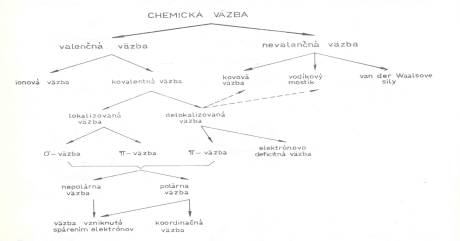
chemických väzieb Ø
Ukázať
študentom, ako navzájom súvisia jednotlivé typy väzieb,
s ktorými sa oboznámime.
Obr. č. 6: Systematika chemických väzieb 4. Fixačná časť: Ø
upevniť učivo pomocou úloh z učebného textu: 1.
Aké je hlavné energetické kritérium pre vznik chemickej
väzby? 2.
Čo udáva množstvo uvoľnenej energie? 3.
Ktorý systém má menšiu energiu: 2 voľné alebo 2
viazané atómy
vodíka? 4.
Aký je rozdiel medzi disociačnou a väzbovou energiou? 5.
Vyberte správne tvrdenie: Väzbová
energia: a) čím je vyššia, tým je väzba pevnejšia
b) čím je nižšia, tým je väzba pevnejšia
c) je väčšia ako disociačná energia
d) je menšia ako disociačná energia 6.
Pri vzniku chemickej väzby sa uvoľní energia, ktorá: a)
je menšia ako energia potrebná na jej rozštiepenie b)
rovnaká ako energia potrebná na jej rozštiepenie c)
je väčšia ako energia potrebná ne jej rozštiepenie 7.
Čím sa pri vzniku väzby uvoľní viac energie: a)
tým je väzba stabilnejšia b)
tým je väzba menej stála c)
tým treba viac katalyzátora d)
tým treba menej katalyzátora 5.
Záver: Ø
nabudúce začneme preberať prvý z typov chemickej väzby:
kovalentnú väzbu
|
Posledná aktualizácia: 05.10.2004