UČEBNÉ TEXTY
|
5.1.1 Väzba σ a väzba π Na
základe symetrie väzbových atómových orbitalov rozlišujeme
kovalentnú väzbu σ
a π. Väzba σ
vzniká prekrytím
atómových orbitalov lokalizovaných na spojnici jadier viažucich
sa atómov.
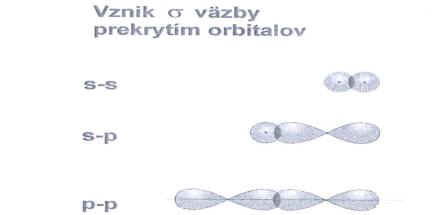
Najväčšia hustota väzbového elektrónového oblaku sa nachádza
na spojnici jadier oboch viazaných atómov. Najčastejšie vzniká väzba σ
prekrytím atómových orbitalov s
– s, s
– p a p
– p, ktoré sú orientované pozdĺž spojnice atómových
jadier. Ak sú atómy v molekule viazané jednou väzbou, je to
väzba σ.
Obr. č. 8: Ukážka vzniku σ
väzby prekrytím orbitalov
s – s, s
– p a p – p
Väzba
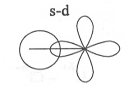
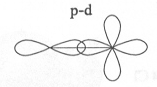
σ
môže vzniknúť aj prekrytím atómových orbitalov s – d, p
– d a d – d.
Obr. č. 9: Ukážka vzniku σ
väzby prekrytím orbitalov
s – d a p – d
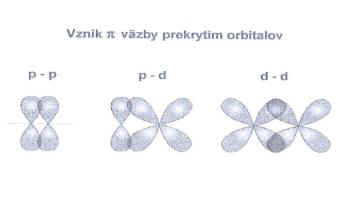
Väzba π
vzniká
prekrytím
atómových orbitalov lokalizovaných kolmo na spojnicu jadier viažucich
sa atómov.
Najväčšia
hustota väzbového elektrónového oblaku je teda symetricky rozložená
mimo spojnice oboch jadier. Táto väzba vzniká pri prekrývaní
orbitalov p – p, p – d a d – d orientovaných
kolmo na spojnicu jadier viažucich sa atómov. Väzba π
vzniká medzi atómami v molekule len vtedy, ak už medzi nimi
existuje väzba σ.
Väzba π
je vždy slabšia ako väzba σ.
Obr.
č. 10: Ukážka vzniku π
väzby prekrytím orbitalov p
– p, p – d a
d – d |
Posledná aktualizácia: 12.05.2008