UČEBNÉ TEXTY
|
Úloha č. 1:
Vznik
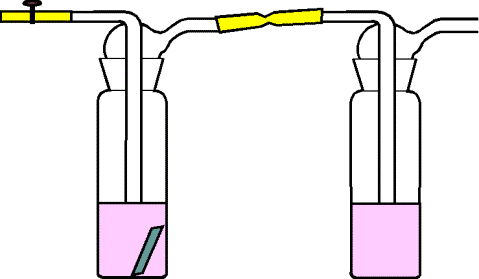
väzby Pomôcky:
2 premývacie fľaše, tlačidlo, hadice (gumové) Chemikálie:
zried. roztok H2SO4, prúžok horčíka, zried.
roztok KMnO4 Pracovný
postup: 1.
Do oboch fliaš nalejeme veľmi zriedený roztok KMnO4
do výšky asi 4cm. 2.
Jednu z fliaš uzavrieme tlačkou na gumovej hadici. Do tejto
flaše pridáme zriedený roztok H2SO4 a prúžok
horčíka. pozorujeme vývoj plynu. 3. Plyn prechádza do druhej premývacej fľaše, sledujeme zmenu farby roztoku. Aparatúra:
Pozorovanie:
Roztok KMnO4 sa odfarbí.
|
Posledná aktualizácia: 05.10.2004