UČEBNÉ TEXTY
|
5.4.1 Van
der Waalsove sily Patria medzi slabé sily pôsobiace medzi časticami vo všetkých
troch skupenstvách a nazvané sú podľa svojho objaviteľa J.
D. VAN DER WAALSA (1873). Podstatou týchto síl je elektrostatické
príťažlivé pôsobenie medzi časticami, ktoré majú určitý
elektrický náboj. 1.
interakcie
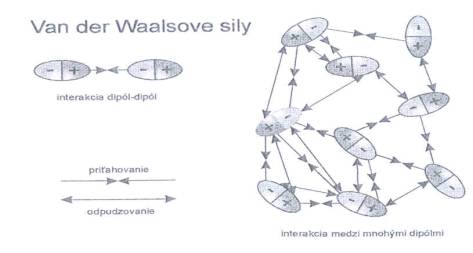
dipól – dipól a ión – dipól Polárne molekuly sa najprv musia k sebe orientovať opačnými pólmi a až potom nastávajú elektrostatické interakcie medzi nimi. Podobne je to aj pri interakcii ión – dipól, kde sa polárne molekuly orientujú opačným pólom k danému iónu a potom dochádza k slabým elektrostatickým interakciám. Tieto interakcie sa uskutočňujú pri rozpúšťaní polárnych látok v polárnych rozpúšťadlách (obr. č. 38).
Obr. č. 38: Ukážka interakcie
dipól – dipól medzi mnohými dipólmi 1.
interakcia
dipól – indukovaný dipól a ión – indukovaný dipól Táto interakcia
vzniká vtedy, ak sa nepolárna molekula dostane do blízkosti polárnej
molekuly alebo iónu so silným polarizačným účinkom. V tomto
prípade polárna molekula indukuje v nepolárnej molekule dipól
a nastane priťahovanie opačne nabitých pólov týchto molekúl.
Príkladom uvedenej interakcie je čiastočné rozpúšťanie nepolárnych
molekúl jódu vo vode. 2.
interakcie medzi nepolárnymi molekulami Tieto interakcie sú
najslabšími zo všetkých medzimolekulových interakcií. Sú
napr. medzi vrstvami uhlíka v grafite, medzi molekulami
kvapalného brómu alebo tuhého jódu.
Ich podstata spočíva v tom, že v atómoch a nepolárnych
molekulách vznikajú rýchlym pohybom elektrónov dočasné (okamžité)
dipóly. Môžeme si to
predstaviť tak, že v určitom momente sa viaceré elektróny
naraz nachádzajú v atóme na jednej strane a vtedy sa na
chvíľu oddelí kladný a záporný náboj v atóme a vznikne
dočasný dipól, ktorý je schopný indukovať takéto dipóly v susedných
atómoch a molekulách, čím vznikne ich elektrostatické priťahovanie. Vlastnosti
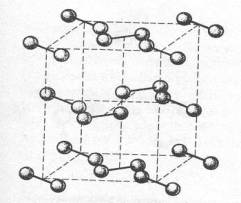
látok obsahujúcich Van der Waalsove sily Látky tohto typu tvoria molekulové kryštály, napr. Br2 (obr. č. 39). Tieto látky majú nízku teplotu topenia a sú prchavé.
Obr. č. 39: Model kryštálovej štruktúry
Br2
Prechodom
medzi atómovými a molekulovými kryštálmi sú vrstevnaté
kryštály.
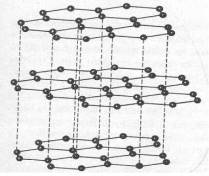
Príkladom vrstevnatej štruktúry je štruktúra grafitu – tuhy (obr. č. 40).
Obr. č. 40: Model kryštálovej štruktúry
grafitu a usporiadanie atómov uhlíka v grafite
(pohľad zhora) Atómy
v jednotlivých vrstvách sú navzájom spojené kovalentnými
väzbami. Medzi vrstvami pôsobia Van der Waalsove sily. Uvedené
väzbové sily spôsobujú, že tuha je mäkká
a ľahko sa otiera.
|
Posledná aktualizácia: 04.10.2004