UČEBNÉ TEXTY
|
5.4.1
Vodíková väzba Vodíková
väzba patrí medzi najsilnejšie medzimolekulové interakcie dipól – dipól,
ktoré vznikajú hlavne v polárnych zlúčeninách, v ktorých
je atóm vodíka viazaný k silne elektronegatívnemu prvku,
napr. HF, H2O, NH3. Vodíková väzba môže vznikať medzi dvoma polárnymi
molekulami, ktoré obsahujú
vodík
a atóm
s veľkou hodnotou elektronegativity, napr. F, O, N, ale aj Cl a S. Vo vzorcoch sa zvýrazňuje bodkovaním:
H – F...H – F...H – F. Atóm vodíka môže byť v zlúčeninách len jednoväzbový,
lebo má len 1 elektrón (v orbitale 1s). Vo veľmi polárnych
molekulách vodík vytvára jednu kovalentnú väzbu a zároveň
sa spája s ďalšou silne polárnou molekulou, čím vzniká intermolekulová vodíková väzba
(vodíkové
mostíky). Takto dochádza k spájaniu molekúl
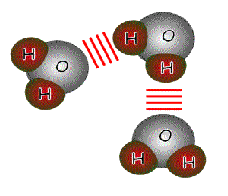
do väčších útvarov. Obr. č. 36: Ukážka 2 rôznych typov znázornenia vodíkových
mostíkov medzi molekulami vody Existencia medzimolekulových síl spôsobuje, že látky
obsahujúce vodíkovú väzbu majú vyššie teploty topenia a varu
ako ostatné hydridy v 15., 16. a 17. skupine PSP. Spájanie molekúl do väčších celkov prostredníctvom
vodíkových väzieb je napr. príčinou, že voda je pri bežných
podmienkach kvapalina.
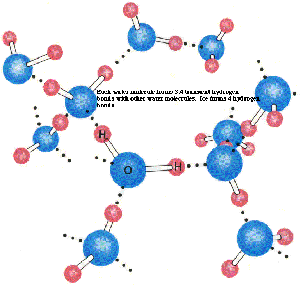
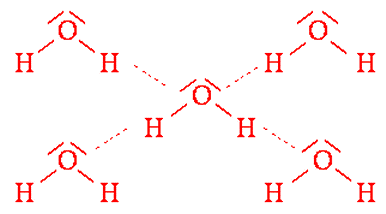
Obr. č. 37: Ukážka vzniku vodíkových väzieb medzi
molekulami vody |
Posledná aktualizácia: 04.10.2004