Oxid
siričitý
1. Príprava oxidu siričitého
Princíp práce
Oxid
siričitý vzniká reakciou siričitanov s kyselinami.
Na2SO3 + 2 HCl
®
2 NaCl + H2O + SO2
Na2SO3 + H2SO4
®
Na2SO4 + H2O + SO2
Siričitanové ióny SO3 2- reagujú
ako silná Bronstedtová zásada (akceptor protónu H+)
za vzniku hydrogensiričitanu HSO3 - a
nestálej kyseliny siričitej H2SO3.
Pomôcky a chemikálie
jednoduchý
vyvíjač plynu, siričitan sodný Na2SO3,
kyselina chlorovodíková HCl alebo kyselina sírová H2SO4
(w=10 %), adsorpčná trubička
 Postup
práce Postup
práce
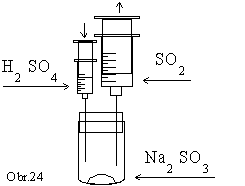
Do
skúmavky jednoduchého vyvíjača plynu dáme 1 lyžičku
siričitanu sodného. K siričitanu sodnému v skúmavke
pomaly prikvapkávame z 5 cm3 injekčnej striekačky
kyselinu chlorovodíkovú alebo sírovú, pričom 50 cm3
injekčná striekačka sa pomaly napĺňa oxidom siričitým.
Po naplnení striekačku odoberieme a na injekčnú ihlu nasadíme
adsorpčnú trubičku (obr.24).
Bezpečnosť
Oxid
siričitý je bezfarebný, veľmi jedovatý plyn štipľavého
zápachu, ťažší ako vzduch. Musíme zabrániť jeho
vdychovaniu! Pred začatím pokusu je preto nutné piest
50 cm3 injekčnej striekačky natrieť tukom
a vyvíjanie plynu robiť pomaly, aby sme zabránili vzniku
pretlaku plynu.
Zneškodnenie splodín
·
Prebytočný oxid siričitý vo
vyvíjači plynu adsorbujeme pomocou adsorpčnej trubičky s aktívnym
uhlím. Prebytočný oxid siričitý v striekačke
zlikvidujeme zavedením plynu do roztoku hydroxidu sodného
NaOH (w=10%).
·
Vzniknuté soli v skúmavke
rozpustíme vo väčšom množstve vody a vylejeme do výlevky.
·
Nespotrebovanú kyselinu vrátime
do zásobnej fľaše.
2.
Vlastnosti oxidu siričitého
Oxid
siričitý je bezfarebný plyn,
štipľavého zápachu, veľmi jedovatý. Je málo
rozpustný vo vode, má redukčné, bieliace a konzervačné
účinky, jeho oxidáciou vzniká oxid sírový (anhydrid
kyseliny sírovej).
a)
rozpúšťanie
oxidu siričitého vo vode
Princíp práce
Oxid
siričitý je málo rozpustný vo vode. Rozpustená časť
oxidu siričitého tvorí slabú kyselinu siričitú:
SO2 + H2O
®
H2SO3
Kyselina siričitá je bezfarebná, nestála kyselina,
zahrievaním sa rozkladá na vodu a oxid siričitý. Nemožno
ju pripraviť ako chemicky čistú látku, je známa len vo
vodnom roztoku.
Pomôcky a chemikálie
50
cm3 injekčná striekačka naplnená plynným
oxidom siričitým, skúmavka, metyloranž prípadne iný
acidobázický indikátor
 Postup
práce Postup
práce
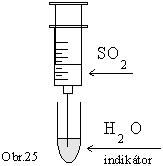
Skúmavku
naplníme vodou, ktorú sme predtým zafarbili indikátorom.
Do vody v skúmavke z injekčnej striekačky pomaly vytláčame
vopred pripravený oxid siričitý (obr.25).
Pozorovanie
Farba
indikátora sa v dôsledku vzniku kyseliny siričitej
zmení (červená).
b)
oxidácia
oxidu siričitého
Princíp práce
Oxid
siričitý sa účinkom katalyzátora za prítomnosti vzdušného
kyslíka oxiduje na oxid sírový – anhydrid kyseliny sírovej:
2 SO2 + O2
®
2 SO3
Pomôcky a chemikálie
skúmavka,
50 cm3 injekčná striekačka s ihlou naplnená
pripraveným oxidom siričitým, železná vlna Fe,
roztok chloridu bárnatého BaCl2, indikátorový
papierik
 Postup
práce Postup
práce
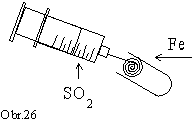
Pripravený
oxid siričitý pomaly vytláčame zo striekačky do rozžeravenej
železnej vlny, ktorú sme zasunuli do ústia skúmavky. V skúmavke
pozorujeme vznik bielej hmly, teda vznik oxidu sírového.
Železnú vlnu vyberieme zo skúmavky a oxid sírový
adsorbujeme s vodou prudkým pretrepaním skúmavky
(obr.26).
Pozorovanie
Rozpustením
oxidu sírového vo vode vzniká kyselina sírová, v ktorej
dokážeme prítomnosť
·
katiónov H+ indikátorovým
papierikom
·
aniónov SO42-
roztokom chloridu bárnatého – vzniká slabý zákal
nerozpusteného síranu bárnatého BaSO4
c)
bieliace účinky oxidu siričitého
Oxid
siričitý má bieliace účinky, ktoré sa využívajú na
bielenie vlny, bavlny apod.
Pomôcky a chemikálie
·
50 cm3 injekčná
striekačka s ihlou naplnená oxidom siričitým, skúmavka, pásiky
filtračného papiera, farebné fixky
·
jednoduchý vyvíjač plynu na
prípravu oxidu siričitého, adsorpčná trubička, lupienky
červených kvetov, siričitan
sodný Na2SO3, kyselina chlorovodíková
HCl alebo kyselina sírová H2SO4
 Postup práce Postup práce
·
Skúmavku naplníme vodou, v ktorej
rozpustíme pripravený oxid siričitý. Do skúmavky potom
vsunieme pásiky filtračného papiera s rôznymi farebnými
čiarami nakreslenými fixkami.
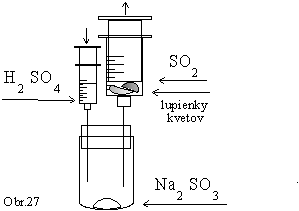
·
Do 50 cm3 injekčnej
striekačky vložíme vodou opláchnuté lupienky kvetov.
Injekčnú striekačku nasadíme na jednoduchý vyvíjač
plynu (obr.27) a naplníme ju oxidom siričitým.
Pozorovanie
·
Na pásikoch filtračného
papiera pozorujeme vybielenie farieb.
·
Kvapky vody na kvete pohltia
oxid siričitý. Vzniká kyselina siričitá, ktorá spôsobí
zmenu sfarbenia kvetov z červeného na slaboružové.
d)
konzervačné
účinky oxidu siričitého
Konzervačné účinky oxidu siričitého sa využívajú na
konzervovanie
ovocia apod.
Pomôcky a chemikálie
2
skúmavky, 2 gumené zátky na skúmavky prepichnuté injekčnými
ihlami, 2 injekčné striekačky s gumeným tesnením na
zachytávanie plynu (V=50cm3), 50 cm3
injekčná striekačka naplnená oxidom siričitým,
hrozienka, droždie, roztok hydroxidu vápenatého Ca(OH)2
Postup práce
Dve
skúmavky naplníme rozdrvenými hrozienkami, ku ktorým pridáme
suspenziu droždia vo vlažnej vode. Do jednej skúmavky vytlačíme
z 50 cm3 striekačky pripravený oxid siričitý.
Obe skúmavky uzavrieme gumenými zátkami a na injekčné
ihly nasadíme prázdne 50 cm3 injekčné striekačky s gumeným tesnením na zachytávanie
plynu.
Pozorovanie
V skúmavke,
ktorej obsah nebol konzervovaný oxidom siričitým začne o
niekoľko minút prebiehať alkoholické kvasenie, pri ktorom
vznikajúci oxid uhličitý začne plniť 50 cm3
injekčnú striekačku. Dôkaz vzniknutého oxidu uhličitého
môžeme urobiť jeho zavedením do čírej vápennej vody
(zakalenie).
V druhej skúmavke, do ktorej sme pridali oxid siričitý,
nepozorujeme žiaden vývoj plynu.
e)
redukčné
účinky oxidu siričitého
Princíp práce
Oxid
siričitý má silné redukčné vlastnosti, ktoré ukážeme
na príklade manganistanu draselného KMnO4 a dichrómanu
draselného K2Cr2O7
Pomôcky a chemikálie
2
skúmavky, vata, 50 cm3 injekčná striekačka s ihlou
naplnená pripraveným oxidom siričitým,
roztok manganistanu draselného KMnO4,
roztok dichrómanu draselného K2Cr2O7,
kyselina sírová H2SO4 (1:3),
destilovaná voda
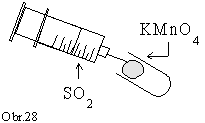 Postup
práce Postup
práce
Do
ústia skúmavky vložíme chumáč vaty navlhčenej fialovým
roztokom manganistanu draselného okysleného kyselinou sírovou.
Do skúmavky pomaly vytláčame zo striekačky
pripravený oxid siričitý. Analogicky postupujeme s roztokom
dichrómanu draselného (obr. 28).
Pozorovanie
Fialový
roztok manganistanu draselného sa odfarbí – vznikne
bezfarebný roztok manganatej soli.
Oranžový roztok dichrómanu prechádza na zelený roztok
chromitej soli.
f)
poznámky
k pokusom
ad c)
bieliace účinky oxidu siričitého
·
Bieliace účinky sa prejavia
len na tých kvetoch, ktoré obsahujú farbivá patriace do
skupiny antokyanov. Sú to prírodné rastlinné farbivá,
ktoré spôsobujú sfarbenie napr. červenej kapusty, klinčekov,
ruží apod.
ad
e) redukčné účinky
oxidu siričitého
·
Roztok manganistanu draselného
pripravíme tak, že do 5 cm3 destilovanej vody
kvapneme opatrne 1 kvapku kyseliny sírovej a potom pridáme
toľko manganistanu draselného, aby sme získali zreteľné
fialové sfarbenie navlhčenej vaty.
[návrat] |