Pravidlá zaplňovania
orbitálov elektrónmi
Aby sme dokázali odvodiť elektrónovú štruktúru atómu určitého
prvku, t. j. usporiadanie všetkých elektrónov
v obale atómu, je potrebné vedieť, v akom poradí sa vytvárajú
jednotlivé orbitály a tiež v akom poradí
sa obsadzujú elektrónmi.
Hodnoty kvantových čísel sa vzťahujú na tzv. základný stav atómu,
t.j. stav atómu s najnižšou energiou.
Elektrónovú konfiguráciu atómov
v základnom stave určujú tri základné pravidlá (princípy):
- Výstavbový princíp
- Pauliho princíp
- Hundovo pravidlo

Výstavbový princíp
Elektrón obsadzuje najskôr ten orbitál,
ktorý má najnižšiu energiu. Energia v orbitáloch závisí
od
hlavného kvantového čísla (s jeho rastúcou hodnotou energia
orbitálu stúpa).Obsadzovanie orbitálov elektrónmi
teda prebieha v poradí:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s,
4d, 5p, 6s, 4f, ....
Toto poradie určuje pravidlo (n+l), kde n je hlavné kvantové číslo,
l je vedľajšie kvantové číslo. Elektróny obsadzujú orbitály
podľa vzrastajúcej hodnoty súčtu n+l, pričom pi rovnakej
hodnote súčtu n+l sa skôr obsadí orbitál s nižšou hodnotou
hlavného kvantového čísla n (orbitál 3p sa obsadzuje skôr ako
orbitál 4s a 4s skôr ako 3d). 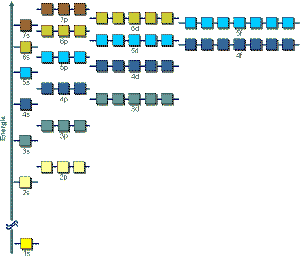

Pauliho princíp
V každom orbitáli môžu byť najviac dva elektróny,
ktoré sa líšia spinovým kvantovým číslom.
Tento princíp vyjadruje zároveň najväžší možný počet
elektrónov v jednotlivých elektrónových vrstvách.Rovná sa
dvojnásobku existujúcich orbitálov v danej vrstve.

Hundovo pravidlo
Orbitály s rovnakou energiou sa obsadzujú najskôr každý
po jednom elektróne. Pritom spinové kvantové čísla
elektrónov v napoly zaplnených orbitáloch s rovnakou energiou sú
rovnaké.Toto pravidlo platí len voľný atóm, a nie pre atóm
viazaný v zlúčeninách.
nesprávne
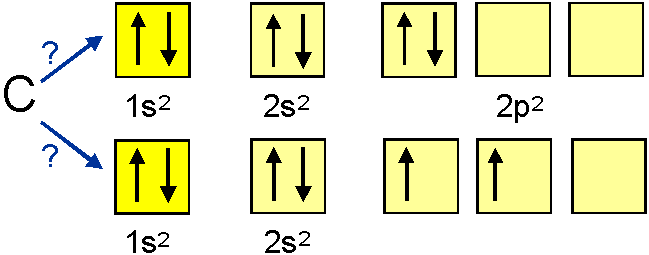
správne

